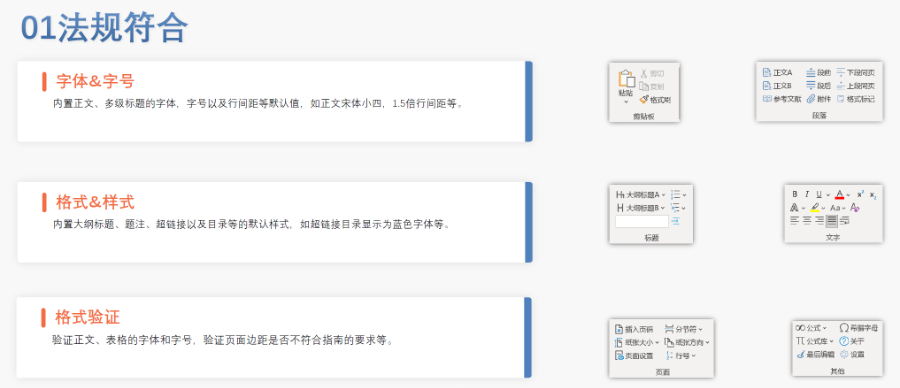
浦东新区eCTD欢迎选购
紧急申报与特殊通道:FDA设置紧急申报通道(如Pre-EUA和EUA),允许在公共卫生事件中快速提交资料。此类申请需在模块1.19注明特殊标识,并通过ESG加急处理。 eCTD版本兼容性与过渡策略:eCTD 4.0支持向前兼容,允许v3.2.2文件无缝过渡。企业需在2024年前完成系统升级,确保XML到HL7 RPS的格式转换。过渡期间需同时维护旧版本系统。 区域差异与全球化协调:美国模块1要求严格,如UUID标识符和组合申请支持,而欧盟侧重文件引用合规性。FDA与PMDA、EMA通过ICH框架协调eCTD标准,但区域特殊性仍需针对性适配。 行业影响与长期价值:eCTD不是技术升级,更是全球药品监管一体化的驱动力。其标准化、可追溯性和效率提升,推动了跨国多中心试验的协同申报,加速创药上市进程。eCTD申报软件相关技术支持。浦东新区eCTD欢迎选购
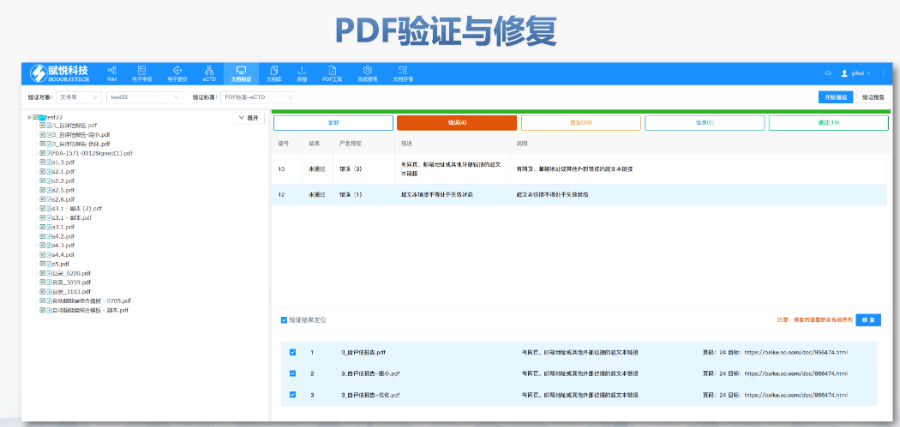
美国电子提交通道ESG(Electronic Submissions Gateway)是美国食品药品监督管理局(FDA)建立的电子化监管信息提交系统,旨在为制药、生物制品、医疗器械等行业提供安全、高效的电子申报服务。自2006年启用以来,ESG已成为FDA接收电子监管材料的入口,每日处理上千份提交文件,涵盖上市前审批、上市后监管、临床试验数据、不良反应报告等多种类型。该系统通过数字证书加密和公钥基础设施(PKI)技术,确保文件传输的真实性、完整性和不可否认性,符合FDA对电子提交的严格合规要求。在技术层面,ESG具备强大的文件处理能力。2018年系统升级后,取消了单个文件8GB的限制,可支持高达35GB的大型文件提交,进一步满足复杂申报需求。此外,文件格式需遵循eCTD(电子通用技术文档)规范,包括模块化结构、PDF标准化和XML元数据整合,以确保全球监管机构兼容性。2025年3月28日起,FDA将启用新一代平台ESG NextGen,逐步替代现有系统,过渡期需关注兼容性和稳定性问题。无锡eCTD哪个品牌好美国eCTD验证标准相关技术支持。
eCTD的法规框架与技术规范:欧盟eCTD的法规层级包括指南(Guidelines)、指令(Directive)和法规(Regulation)。其中,法规(如CTR)具有直接法律效力,而指南(如ICH eCTD规范)则为技术操作提供参考。eCTD的结构需符合欧盟模块1规范(DTD 3.0+),包含行政文件(模块1)、质量数据(模块3)及临床研究报告(模块5)等内容,并通过XML文件实现数据互联。例如,CEP(欧洲药典适用性证书)的eCTD申报需单独构建信封(Envelope)和模块1,并指定标识符(UUID)以确保技术合规性。
eCTD的实施为监管机构和企业带来了多重机遇。电子化申报资料能够极大地加速审评效率,减少人为判断错误和数据混淆的情况,从而提高审评的准确性和速度。同时,eCTD带来的数据标准化机遇使得全球监管机构的资料内容和电子格式得以统一,有助于在不同监管机构之间进行数据传输和共享。这对于提升全球监管效率和行业研发效率具有重要意义。 此外,eCTD的实施还促进了国际合作,构建了全球监管的底层大数据基础。对于企业而言,eCTD提供了一个规范化的研发活动模板,有助于降低与监管机构沟通的成本,提高申报效率。特别是对于国内的生物技术企业而言,eCTD的实施更是具有重要意义,有助于这些企业更好地走向国际市场。然而,中小企业在享受这些机遇的同时,也面临着技术和成本压力。eCTD的实施需要专门的团队进行系统维护和开发,这对于中小企业来说是一笔不小的开支。同时,数据安全问题也是企业关注的焦点。 此次CDE扩大eCTD实施范围对行业而言是一个积极的风向标。短期内,企业面临的挑战包括适应更高要求的技术规范并提高文件质量、和eCTD出版系统的磨合以及进行eCTD知识的跨职能培训等。 美国NDA注册申报相关技术支持。

ANDA递交: 按照ICH M4的CTD格式整理资料,并以eCTD格式递交; 通过ESG通道递交资料; 收到CDER的letter,说明资料已经进入FDA数据库; 付GDUFA费,在资料递交后的10日内到账; ANDA接收: 缴费后,FDA初步审查资料的完整性,并会在60天给答复。 第一种情况是ANDA无缺陷,FDA给申请人发受理信(Acceptance Letter); 第二种情况是ANDA包含少于10个小缺陷,FDA将会通过电话、传真、电子邮件等方式通知发布IR (信息请求函),让申请人在7个日历日内改正,若未按时补充所有需要的资料,FDA将拒收该ANDA; 第三种情况是ANDA包含1个或者多个重大缺陷,或10个以上的小缺陷,FDA将拒收该ANDA; 注:如果这边被拒收,只退75%的费用。瑞士eCTD验证标准相关技术支持。无锡仿制药eCTD便宜
澳大利亚DMF注册申报相关技术支持。浦东新区eCTD欢迎选购
区域化差异与多国协作挑战 欧盟eCTD需兼容成员国特定要求,例如模块一的行政信息需符合各国语言和法规差异。互认程序(MRP)中,参考成员国(RMS)的评估报告需被其他成员国认可,若出现分歧需由CMDh协调或提交EMA仲裁。这种多层级审评机制要求申请人在文件准备阶段即考虑区域兼容性,避免后续流程延误。 eCTD4.0的探索与未来方向 ICH于2015年发布的eCTD4.0版本旨在简化目录结构、支持多产品类型(如医疗器械)申报,并增强生命周期管理功能。欧盟计划通过2024年试点逐步过渡至4.0,其扁平化文件组织方式有望减少重复提交并提升审评效率。然而,实施需解决现有系统兼容性及行业适应性问题。浦东新区eCTD欢迎选购
赋悦科技(杭州)有限责任公司是一家有着雄厚实力背景、信誉可靠、励精图治、展望未来、有梦想有目标,有组织有体系的公司,坚持于带领员工在未来的道路上大放光明,携手共画蓝图,在浙江省等地区的数码、电脑行业中积累了大批忠诚的客户粉丝源,也收获了良好的用户口碑,为公司的发展奠定的良好的行业基础,也希望未来公司能成为*****,努力为行业领域的发展奉献出自己的一份力量,我们相信精益求精的工作态度和不断的完善创新理念以及自强不息,斗志昂扬的的企业精神将**赋悦科技供应和您一起携手步入辉煌,共创佳绩,一直以来,公司贯彻执行科学管理、创新发展、诚实守信的方针,员工精诚努力,协同奋取,以品质、服务来赢得市场,我们一直在路上!
上一篇: 安徽赋悦科技eCTD报价
下一篇: 杭州赋悦科技eCTD注册系统